「我們公司怕死了!」中磊電子總經理王煒說。他很擔心,最近大批從歐美疫區回國的年輕學生、遊子,將讓台灣爆發新一波感染潮。
「一堆人回到台灣,一定有人跑出來亂走亂跑!晚上幹什麼我都不知道,」他說。
王煒認為,政府該比照「韓國模式」,大量檢測。
「台灣沒有辦法做到,我們比不過韓國,整個檢測的capacity遠遠不如他們,我們可能是他們一個數量級的差別。」
新冠肺炎檢測戰,南韓堪稱全球模範生。大邱市新天地教會爆發大規模群聚感染,單日新增確診數逼近千例,一度被認為是全球疫情重災區。但之後疫情迅速收斂,關鍵就在於大規模篩檢找出病人,杜絕疫情擴散。
在不封城的狀況下,南韓從疫情爆發的大邱市開始進行普篩,無論有無症狀一律採檢。
迄今全南韓有600多個檢測站和逾100座實驗室,並廣設「得來速篩檢站」,只要開車到指定地點,打開車窗即可完成問診、測量體溫與篩檢,每日檢驗量可達上萬件,已有約30萬人接受病毒檢測,近期更啟動自歐洲入境旅客全面採檢。
大規模採檢的背後,有賴於南韓政府與生技業者在疫情初期,就著手進行病毒核酸檢測試劑的研發與生產,並予以緊急批准。迄今該國每日可生產10萬個檢測試劑盒,還有餘裕可出口他國使用。
問:南韓可以大量普篩,最近更讓歐洲入境旅客全面採檢。韓國可以,為什麼台灣不能?
答:入境全數居家檢疫最保險。而且,檢驗試劑數量有限,得未雨綢繆,為萬一疫情擴大時預作準備。
要不要擴大對歐美旅客的檢測範圍?衛福部長陳時中於30日記者會上首度鬆口,「考慮針對某些風險高的區域,採用特別的做法。」
中央流行疫情指揮中心發言人莊人祥進一步說明,目前我國僅允許本國籍旅客入境,若有症狀在機場就會採檢;而且入境者全面居家檢疫14天,期間若有不適也可隨時通報採檢,這其實是比較保險的作法。
陳時中便認為,若對入境者全面採檢,仍可能有無症狀感染者檢驗後呈現偽陰性而鬆懈下來,沒有居家隔離,反而增加社區感染風險。

事實上,我國未比照韓國「普篩」模式,檢驗量能也是現實考量之一。目前國內檢測新冠病毒合約實驗室雖已擴增至34家,每日檢驗量可達3800件,但比起南韓的每日上萬件,仍差一大截。
而且,指揮中心官員透露,1月下旬我國出現首例確診患者之際,當時研判疫情會持續升溫,馬上啟動檢測試劑採購,現已備有數十萬劑寶貴的檢測試劑。如今歐美疫情失控,各國搶購試劑,試劑價格水漲船高,甚至有行無市。
因此,我國檢測試劑雖尚稱足夠,但必須未雨綢繆,以備台灣日後萬一像歐美國家突然爆發大規模疫情,仍有足夠的檢驗量能因應。
問:新冠病毒檢測可以像流感檢驗一樣,有快篩可以用嗎?
答:核酸檢測是黃金標準,血清抗體快篩準確度低,只能輔助使用。
新冠病毒狡猾多變,全世界科學家都在找偵測新冠病毒快又準確的方式,核酸檢測是目前診斷的「黃金標準」,特異性強、靈敏度高是其特性,經過採樣、樣本處理、核酸萃取,再進行RT-PCR檢測,待結果出爐需花4~6小時,且要在實驗室內由專業人員操作。
近日國內外不斷有快速檢測試劑問世,宣稱可縮短檢測時間。
美國食品藥物管理局(FDA)日前批准首款新冠病毒快速診斷檢測儀器,核酸檢測時間可縮短至45分鐘,中央流行疫情指揮中心也透露將尋求採購,以機器自動化取代人工萃取核酸,節省檢測時間。
除核酸檢測外,檢驗血清抗體與病毒抗原,都可研判是否染疫。
美國生技公司BioMedomics宣稱開發出全球第一款新冠病毒血清抗體快篩試劑組,透過少量血液檢測IgM和IgG抗體,15分鐘內可知結果。

「一滴血15分鐘見結果」的快篩試劑,在中國更如雨後春筍般出現。中國國家藥品監督管理局於2月下旬首度批准新冠病毒血清抗體檢測試劑上市;截至3月27日,中國共核准23項檢測產品,其中8款為抗體檢測。而歐盟也已批准至少5款抗體快篩試劑產品。
位於台中的明傑企業社,於2月下旬就向中國生技公司採購2000份血清抗體快篩試劑,日前獲衛福部食藥署專案輸入核准。
負責人陳志富表示,血清抗體檢測是採血,不會像核酸檢測受採檢部位影響,導致結果失準的問題。
陳志富透露,依我國法規,輸入產品須取得當地核准,還要有足夠案例數,因而選擇中國的產品。世界各國都在瘋搶試劑,還得「用現金去搶」。未料獲准輸入後,意外牽動兩岸敏感神經,陳志富嘆,目前仍在觀望,是否上市得看指揮中心決定。
而疫情大爆發的美國,迄今美國FDA對血清抗體檢測態度保留,截至3月24日,獲緊急使用授權(EUA)的診斷試劑共15件,全是核酸檢測試劑。
此舉遭美籍華裔病毒學家何大一批評,他認為,血清抗體檢測也是重要篩檢工具,中國、南韓與歐盟都已採用,FDA卻遲遲未作為,就保護公眾而言是弊大於利。
因應試劑短缺,FDA日前緊急修改規定,放寬相關限制,業者在取得緊急授權前可販售血清抗體試劑,在非唯一診斷依據下輔助使用。
為何抗體檢測只能做為輔助?台灣研發型生技新藥發展協會理事長張鴻仁解答,核酸檢測是直接找出病毒基因,但抗體試劑則牽涉生物化學反應,準確度不高,偽陰性或偽陽性都可能發生,最大好處是「快又便宜」。
中研院基因體研究中心特聘研究員謝世良也解釋,人體病毒感染後,約經5至7天會先後產生IgM與IgG抗體,IgM抗體陽性代表近期或正被感染,IgG抗體陽性則表示曾經感染。因此血清抗體檢測陽性,其實代表已是感染的中、晚期。
換言之,抗體檢測時間雖可縮短到約15分鐘,但準確度不比核酸檢測,更無法揪出感染初期患者。


問:既然國外已有這麼多種快篩試劑上市,中研院開發出來的抗原快篩,為什麼還備受期待?
答:可以揪出早期感染患者。
如何找到可辨識新冠病毒的關鍵抗體,早期偵測病毒,開發出病毒抗原快篩試劑,是科學界一大難題。中國雖有業者聲稱開發出抗原快篩,但迄今未獲官方批准。
3月8日,中研院基因體研究中心楊安綏實驗室團隊在短短19天內,找出能辨識新冠病毒核蛋白的單株抗體群,可望進一步製造出抗原快篩試劑。

他表示,這種試劑與國外普遍的抗體快篩試劑相較,性能更為優越,因為患者在新冠病毒感染後才會產生抗體,「而抗原大量產生時,才是一般感染人員最具傳染性的時候,」楊安綏說。
快速找到關鍵抗體,核心技術在於楊安綏團隊獲美國與台灣專利的「合成抗體庫技術平台」。中研院長廖俊智說明,合成抗體庫技術平台是透過先進的計算技術,以人工方式取代人體細胞製造出各種變異抗體,以辨識出病毒抗原,主要應用在傳染病快篩試劑開發,以及可作為藥物使用的中和性抗體。
學術界的「抗疫國家隊」中研院率先達陣,國衛院則是從SARS研發經驗累積,鎖定幾株抗體群,已通過病毒蛋白質測試,日前也取得病毒株,正在進行病毒測試。
長庚團隊則以臨床病人抗體庫為後盾,長庚大學新興病毒感染研究中心主任施信如說,已找出3株具潛力的抗體,經純化放大,再以6株來源不同的病毒測試,不僅可開發快篩試劑,還可望帶來治療曙光。
「全世界都在拚快篩,特別是中國大陸,有很多研發團隊在進行,開發抗體速度決定快慢,但快慢不是絕對,靈敏度才是關鍵!」國衛院感染症與疫苗研究所生物製劑廠執行長劉士任說。
問:我國國產快篩試劑何時能上市?
答:之前登革熱快篩試劑光臨床就耗了16個月,但這次可能以緊急授權方式,縮短時間。
各界引頸期盼期盼快篩試劑上市,在醫療第一線提供患者使用。廖俊智透露,實驗室成功後,最快3月底會技轉廠商,目前有7家廠商表示興趣。
但技轉之後,找到足夠的患者來做臨床試驗,才是真正挑戰。
國產快篩試劑開發有前例,亞洲基因參與疾管署登革熱NS1抗原快篩試劑技轉評選出線之後,因臨床檢體取得不易,得一一招募並取得患者同意,並給予受試者3000元營養費。
亞洲基因快篩檢測事業部副總經理蔡維仁表示,即便當年正值高雄登革熱大流行,仍花了16個月,才蒐集到100件臨床檢體。
新冠病毒快篩試劑開發,臨床檢體取得也是問題。張鴻仁也直言,台灣確診案例相對少,後續開發不可能有優勢,「不是疫區,就不可能研發第一。」
一名國內生技業者指出,以往向食藥署辦理醫材查驗登記,有時遊戲規則不明,常讓廠商無所適從。
但本次新冠病毒快篩試劑開發,在國家主導下,食藥署已配合國家政策,開設專責窗口協助廠商,甚可能比照國外採緊急授權,予以臨時查驗登記,臨床檢體數要求可能較低,規定也會更明確。而且近日個案數急速增加,臨床檢體取得或許較容易,有機會盡快促成快篩試劑問世。
快篩準確度也是一大考驗,陽明大學副校長、前衛生署食品藥物管理局長康照洲提到,流感或登革熱快篩準確度頂多7至8成,未來中研院快篩問世,準確度達5到6成就算不錯。
但他認為,快篩試劑操作容易,在診所就能初步篩檢,能分擔實驗室檢驗量。(責任編輯:吳凱琳)
天下編輯精選國內外新聞,每天早晨發送,也可以聆聽語音朗讀
編輯精選新聞,早晨寄送
請查看您的信箱,我們將寄送驗證信給您,確保未來信件會送到您的信箱


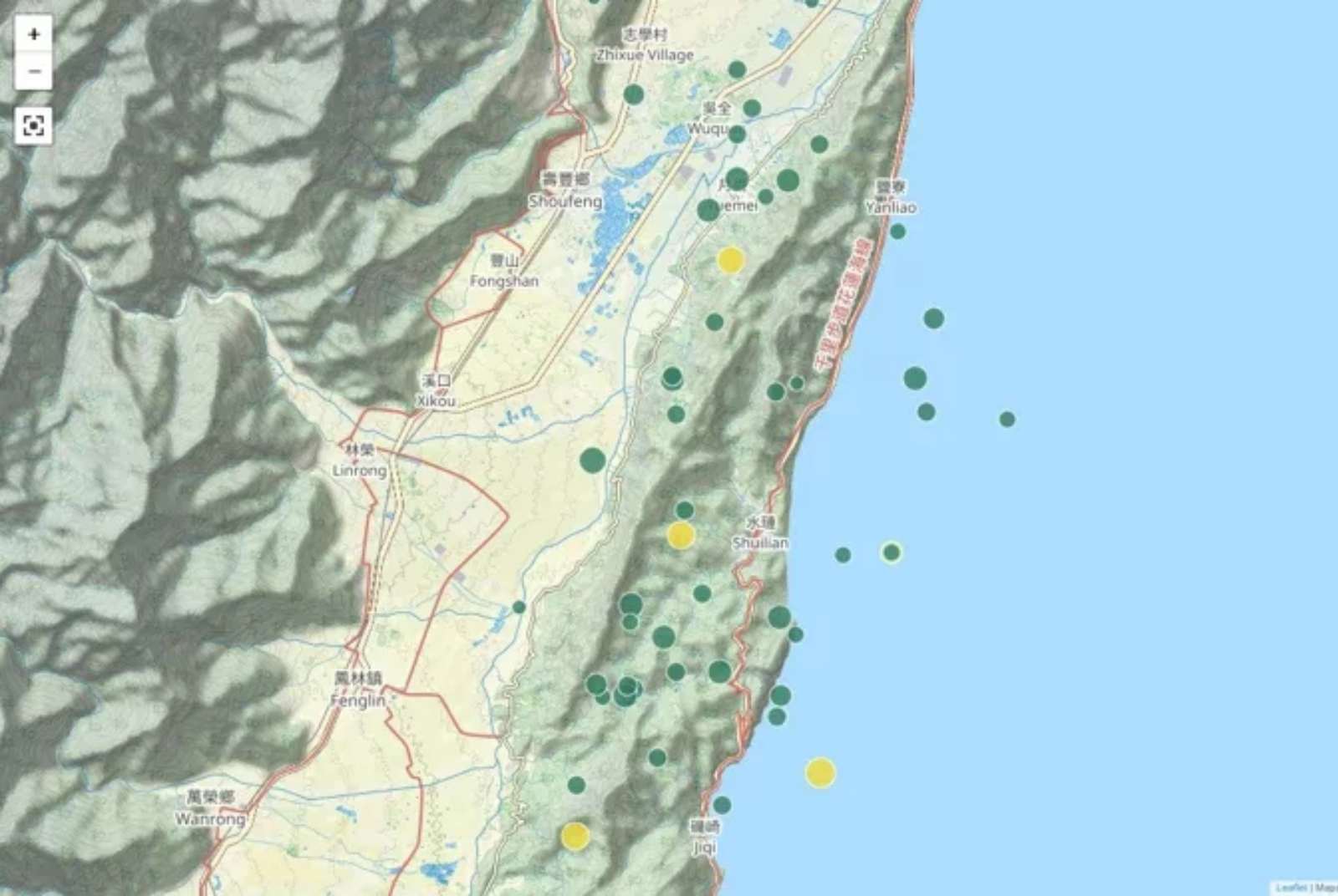



 境外移入案例這麼多,為什麼台灣遲遲不對歐美旅客全面篩檢?
境外移入案例這麼多,為什麼台灣遲遲不對歐美旅客全面篩檢?